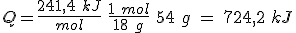1.5 Ecuaciones termoquímicas y diagramas entálpicos
Si en una ecuación química detallas el calor intercambiado, estás escribiendo una ecuación termoquímica. Fíjate en cómo se escribe en el caso de la formación de agua:
H2(g) + ½ O2(g) → H2O(g) ; ΔH = –241,4 kJ
ΔH depende de la cantidad de sustancia que se
forma o produce. Por tanto, si se ajusta poniendo coeficientes dobles, habrá
que multiplicar ΔH por 2, ya que reacciona el doble de sustancia y lógicamente se intercambiará el doble de energía:
Diagramas de entalpía
En la reacción anterior la variación de entalpía es negativa, por lo que, en las proporciones estequiométricas del proceso, el agua tiene menos entalpía que entre el oxígeno y el hidrógeno.
Se suelen representar diagramas energéticos para dar una idea gráfica del contenido energético de reactivos y productos. En la imagen puedes ver tanto un proceso exotérmico como el anterior, como uno endotérmico, en los que se representan los niveles de energía química (de entalpía) de reactivos y productos
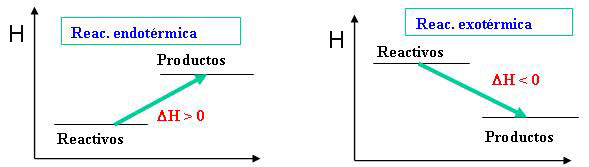 |
| Imagen 9 Elaboración propia |
Evolución en sistema aislados
Ten siempre presente que los diagramas energéticos se refieren a sistemas aislados, en los que la energía total es constante porque no se puede intercambiar energía ni materia con el entorno.
En el caso de un proceso exotérmico, en los que se produce un desprendimiento de energía en forma de calor, ¿de dónde sale esa energía? El calor desprendido al producirse la reacción química lo absorbe el propio sistema, incrementando su temperatura y calentándose. Pero si aumenta la energía térmica del sistema, debe disminuir la química (¡la entalpía!), ya que la energía total, suma de la térmica y la química, es constante.
Temperatura y entalpía de reacción
En los procesos exotérmicos se produce un aumento de temperatura (aumenta la energía térmica), y la entalpía de los productos es menor que la de los reactivos (disminuye la entalpía).
En los procesos endotérmicos se produce una disminución de temperatura (disminuye la energía térmica), y la entalpía de los productos es mayor que la de los reactivos (aumenta la entalpía).
Es fácil que tengas en casa alcohol de quemar (metanol) o bien disolvente de laca de uñas (acetona). Vas a realizar una pequeña experiencia con ellos: deja caer unas gotas del líquido de que dispongas en el dorso de la mano, y espera a que se evapore.
a) ¿Se trata de un proceso físico o químico?
b) El líquido ¿es poco volátil o muy volátil?
c) ¿Qué sensación has tenido al evaporarse el líquido?
d) Deduce el carácter térmico del proceso (si es endo o exotérmico).
e) Justifica tu respuesta basándote en interacciones entre moléculas.