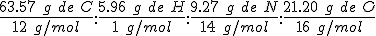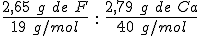2. La fórmula de las sustancias
 |
| Imagen 11 Elaboración propia |
En el caso de las sustancias que forman estructuras gigantes, la fórmula indica la proporción de átomos o de iones en el compuesto. Si se trata de moléculas, la fórmula indica el número de átomos de cada tipo en la molécula.
Por ejemplo, la fórmula SiO2 indica que en la sílice hay el doble de átomos de oxígeno que de silicio, ya que no se forman moléculas sino una estructura gigante. A veces se representa su fórmula empírica como (SiO2)t. En el caso del K2O, hay el doble de iones K+ que O2-. Sin embargo, NH3 indica que en la molécula de amoniaco hay unidos tres átomos de H y uno de N.
En primer lugar, hay que determinar la proporción de átomos o iones de cada tipo en el compuesto; es decir, la fórmula empírica. Por ejemplo, para una sustancia molecular (CxHyOz)t significa que en la sustancia hay x átomos de C por cada y átomos de H por cada z átomos de O. Si es una molécula, su fórmula será CxHyOz, C2xH2yO2z, C3xH3yO3z, etc, ya que en todos esos casos la proporción es la misma; para concretar la fórmula molecular habrá que saber también la masa relativa o la molar.
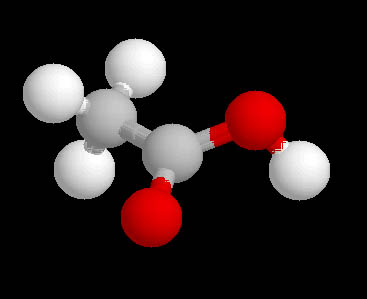
En la imagen puedes ver la molécula de ácido acético, en la que hay dos átomos de carbono (gris), cuatro de hidrógeno (blanco) y dos de oxígeno (rojo). La fórmula empírica es (CH2O)2, y la molecular C2H4O2.
Para determinar la fórmula empírica se necesita saber la masa de cada elemento que hay en una cantidad determinada de compuesto, que se da directamente o se puede obtener a partir de otros datos. También se puede facilitar la composición centesimal, ya que indica la masa de cada elemento que hay en 100 g de compuesto.
Para pasar del nivel experimental (masas de cada elemento) al atómico (número de átomos de cada tipo), se calcula la cantidad de sustancia de cada elemento.
masa ------> cantidad de sustancia ------>relación en moles (se divide por el más pequeño)------> relación en átomos (debe estar que la misma relación en átomos pero con números enteros y sencillos)
Las proporciones de combinación en masas o cantidades de sustancia se indican con dos puntos (:). Se deben escribir con el mismo número de cifras significativas que los datos proporcionados.
Como la proporción de átomos en el compuesto ha de ser necesariamente de números enteros (no hay fracciones de átomo), es necesario hacer la transformación correspondiente. Para ello, se divide cada número de la proporción por el más pequeño de ellos, y se transforma el resultado a proporción de números enteros.
Ahora ya tienes la fórmula empírica, que marca la proporción de átomos o iones en el compuesto. Si se trata de una estructura gigante, ya has obtenido el resultado final.
Si es una sustancia molecular, debes saber el número exacto de átomos de cada tipo. Por ejemplo, si la proporción es 1 átomo de X por cada 2 de Y, la molécula puede tener un átomo de X y 2 de Y, o 2 de X y 4 de Y, o 3 de X y 6 de Y, etc. Si sabes la masa molar de la sustancia podrás concretar el número exacto de átomos de cada tipo que hay en la molécula.