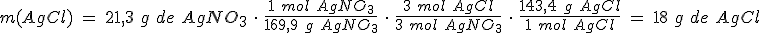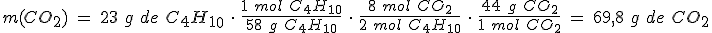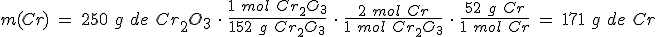3.1. Ejercicios con reactivo limitante
Cuando en una reacción química intervengan cantidades de dos o más reactivos, antes de realizar los cálculos estequiométricos debes determinar cuál es el reactivo limitante, ya que será la referencia para todos los cálculos relacionados con la ecuación química ajustada.
| |
| Imagen 10. The mad scientis, dominio público |
Haces reaccionar 21,3 g de nitrato de plata con 33,5 g de cloruro de aluminio para preparar cloruro de plata y nitrato de aluminio. ¿Cuál es el reactivo limitante?
Masas atómicas relativas: N = 14 ; O = 16 ; Al = 27 ; Cl = 35,5; Ag = 107,9
 |
| Imagen 11. Anders Adermark, Creative commons |
El butano (C4H10) se utiliza como combustible, tanto para cocinar y en tener calefacción y agua caliente. El C4H10 se combina con el oxígeno para formar dióxido de carbono y agua.
Si haces reaccionar 23 g de butano con 96 g de dioxígeno, ¿qué masa de CO2 se desprenderá?
Masas atómicas relativas: H = 1; C = 12 ; O =16
-oxide-sample.jpg) |
| Imagen 12. Benjah-bmm27, dominio público |
Para obtener metales de gran pureza a partir de sus óxidos, se hace reaccionar el óxido del metal con polvo de aluminio (termita).
Cuando haces reaccionar 250 g de trióxido de dicromo con 100 g de aluminio, se forma cromo y óxido de aluminio. ¿Cuál es la masa de cromo que obtienes?
Masas atómicas relativas: O = 16; Al = 27 ; Cr = 52
 Al(NO3)3
+ 3AgCl
Al(NO3)3
+ 3AgCl