3.4. Energía térmica
Si pudieramos observar una sustancia a nivel molecular veríamos que sus moléculas no están quietas, se agitan a diferentes velocidades. Cada una de estas partículas tiene pues una energía cinética. Para conocer la energía total de este tipo que tiene un sistema habría que sumar las energías cinéticas de todas sus moléculas, esto es algo que no tiene sentido.
En su lugar se define una propiedad macroscópica que nos indica el grado de agitación que en promedio tienen las moléculas. Esta propiedad es la temperatura.

|
| Imagen 14. Termómetro de mercurio |
Temperatura:
Magnitud que indica el grado de agitación de las moléculas de una sustancia, su valor está asociado a la energía cinética promedio del sistema.
Energía térmica:
Energía que tiene un sistema debida a la agitación de las moléculas que lo forman.
Energía que fluye desde un cuerpo que se encuentra una cierta temperatura a otro que se encuentra a una temperatura inferior.
Cuando dos cuerpos a diferente temperatura alcanzan el equilibrio térmico (cuando sus temperaturas se igualan), la cantidad de energía que ha pasado del cuerpo "caliente" al "frío" en forma de calor depende de tres factores:
- La masa del sistema (m)
- De un coeficiente llamado calor específico (ce). Este valor es característico de cada sustancia e indica la cantidad de calor que hay que suministrar a un kg de material para aumentar su temperatura un grado kelvin.
- Del incremento de temperatura del elemento: (ΔT = Tf-Ti), donde Tf es la temperatura final que ha alcanzado el sistema y Ti es la temperatura inicial del elemento.
Es decir:
El calor comunicado o desprendido para que un sistema de m kg pase de una temperatura inicial Ti a una temperatura final Tf viene dado por:

Donde ce es el calor específico de la sustancia.

|
| Imagen 15. Transmisión de calor por convección |
Formas de intercambio de la energía térmica
La energía térmica o calorífica se puede transmitir de tres formas diferentes:
- Radiación: El calor se transmite en forma de ondas electromagnéticas, de modo que un cuerpo más cliente irradia calor en todas las direcciones.
- Convección: Este tipo de transmisión se da en los fluidos, tanto líquidos como gaseosos, ya que al calentarse disminuyen su densidad y pasan sus moléculas a ocupar la zona superior , por lo que el lugar vacante es reemplazado por nuevas moléculas frías, estableciéndose una corriente llamada convección.
- Conducción: El calor es transmitido entre dos cuerpos que tengan diferentes temperaturas por medio de un contacto físico, hasta que se igualen las temperaturas de los cuerpos.
| Sustancia | Fase | cp (másico) kJ Kg−1 K−1 | cp (molar) kJ mol−1 K−1 |
|---|---|---|---|
| Gas monoatómico (Ideal) | gas | 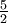 R = 20.8 R = 20.8 |
|
| Helio | gas | 5,1932 | 20,8 |
| Argón | gas | 0,5203 | 20,8 |
| Gas diatómico (Ideal) | gas | 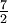 R = 29.1 R = 29.1 |
|
| Hidrógeno | gas | 14,30 | 28,82 |
| Nitrógeno | gas | 1,040 | 29,12 |
| Oxígeno | gas | 0,918 | 29,4 |
| Aire (en condiciones típicas de habitación[3]) | gas | 1,012 | 29,19 |
| Aluminio | sólido | 0,897 | 24,2 |
| Amoniaco | líquido | 4,700 | 80,08 |
| Antimonio | sólido | 0,207 | 25,2 |
| Arsénico | sólido | 0,328 | 24,6 |
| Berilio | sólido | 1,82 | 16,4 |
| Cobre | sólido | 0,385 | 24,47 |
| Diamante | sólido | 0,5091 | 6,115 |
| Etanol | líquido | 2,44 | 112 |
| Gasolina | líquido | 2,22 | 228 |
| Oro | sólido | 0,1291 | 25,42 |
| Grafito | sólido | 0,710 | 8,53 |
| Hierro | sólido | 0,450 | 25,1 |
| Plomo | sólido | 0,127 | 26,4 |
| Litio | sólido | 3,58 | 24,8 |
| Magnesio | sólido | 1,02 | 24,9 |
| Mercurio | líquido | 0,1395 | 27,98 |
| Neón | gas | 1,0301 | 20,7862 |
| cera de parafina | sólido | 2,5 | 900 |
| Sílice (fundido) | sólido | 0,703 | 42,2 |
| Uranio | sólido | 0,116 | 27,7 |
| Agua | gas (100 °C) | 2,080 | 37,47 |
| Agua | líquido (25 °C) | 4,1813 | 75,327 |
| Agua | sólido (0 °C) | 2,114 | 38,09 |
| Todas las medidas son a 25 °C a menos que se indique lo contrario, Los mínimos y máximos notables se muestran en negrita. |
|||
Este artículo es licenciado debajo deLicencia De la Documentación Libre del GNU. Usa material delArtículo"calor específico".
¿Cómo se definen las distintas escalas termométricas?
- http://www.textoscientificos.com/fisica/escalastermometricas
Animación flash de cambio de unidades de temperatura.
