1. Teoría electrónica de Lewis
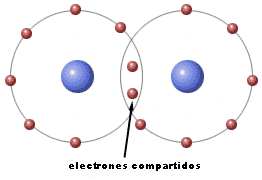
Cuando reaccionan dos átomos que necesitan electrones para adquirir configuración electrónica de gas noble y cumplir la regla del octeto, la única posibilidad es que compartan electrones. Las estructuras electrónicas resultantes se llaman estructuras de Lewis y permiten explicar la formación de enlaces covalentes.
Esta teoría electrónica explica también la formación de enlaces covalentes entre elementos metálicos y no metálicos en los que la diferencia de electronegatividad no es muy elevada, con lo que no llegan a formarse iones por transferencia electrónica.
Asimismo, se explican con facilidad sustancias covalentes como el diamante o la sílice.
 |
 |
| Imagen 2 Elaboración propia |
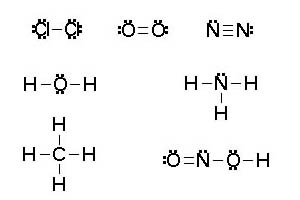
Imagen 3 Elaboración propia |
¿Cómo se representan las estructuras de Lewis?
- Se determina el número de electrones de la capa más externa de todos los átomos de la sustancia (1 en H, 4 en C, 5 en N, 6 en O, 7 en Cl, etc) y se establece el número total de pares de electrones a distribuir.
- Se colocan los átomos unidos entre sí por un par de electrones. Las distribuciones espaciales de átomos suelen ser simétricas.
- El número de pares resultante se reparte entre todos los átomos de manera que se cumpla la regla del octeto.
- Cada par de electrones se representa por dos puntos o una raya.
- Si no hay suficiente número de pares de electrones, se utilizan enlaces dobles o triples para alcanzar el octeto.
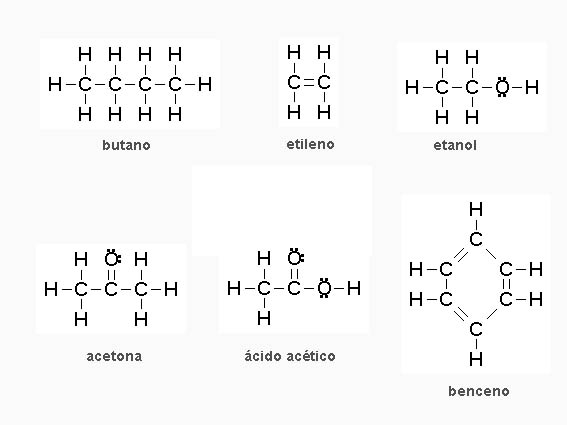 |
| Imagen 4 Elaboración propia |
La regla del octeto no siempre se cumple
Ya viste en el tema anterior que el S está rodeado por seis pares de electrones en el ácido sulfúrico (H2SO4). Es decir, que la regla del octeto tiene excepciones: el nitrógeno está rodeado por cinco pares de electrones en el ácido nítrico (HNO3), pero el boro solamente por tres pares en el BF3, y el berilio por dos en el BeCl2. ¡Y en todos los casos se trata de moléculas estables!
Resonancia
Hay moléculas que no se pueden representar por una única estructura de Lewis, sino que hay varias que pueden ser posibles. Ninguna de ellas representa la situación real de la molécula, que se dice que es un híbrido de resonancia de las formas que la representan.
El benceno es uno de los casos más importantes. Tiene seis átomos de carbono y otros seis de hidrógeno. Si te fijas, verás que hay tres dobles enlaces alternos en cada forma resonante, pero los enlaces entre átomos de carbono son de fuerza intermedia entre el sencillo y el doble. El benceno se suele representar tal y como se muestra en la parte derecha de la imagen.
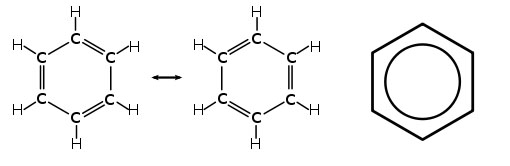 |
| Imagen 5 Shizhao, Dominio público |