2.1 Configuraciones electrónicas
¿Qué relación tienen las estructuras electrónicas de los elementos con su situación en la tabla periódica? Para averigüarlo, vas a utilizar el simulador siguiente.
|
|
| Simulación 1 Educaplus, Uso educativo |
1. Pulsa sobre el elemento 1 (Hidrógeno) y repite con todos los elementos del mismo grupo: observa sus estructuras electrónicas. Verás que todos tienen solamente un electrón en la capa más externa, en un orbital ns, donde n es el número del periodo (por ejemplo, el K está en el cuarto periodo y su electrón más externo está en el orbital 4s).
2. Repite el proceso con los elementos de la segunda columna (alcalinotérreos). Todos tienen dos electrones en la capa más externa.
3. ¿Y los gases nobles, situados en la columna de la derecha? Tienen la capa más externa completa.
4. Por último, a los halógenos, situados en la penúltima columna, les falta un electrón para completar la capa más externa.
- Dentro de un mismo grupo todos los elementos tienen la misma configuración electrónica en su última capa (conocida como capa de valencia), en la que tienen tantos electrones como el número del grupo en que se encuentran.
- En los elementos de un mismo periodo el último electrón está situado en la misma capa, que corresponde al número de periodo. Puedes comprobarlo utilizando cualquiera de los simuladores disponibles.
Zonas de la tabla
Por último, vas a aprender cómo sabiendo dónde está un elemento en la tabla puedes escribir su configuración electrónica, y cómo sabiendo ésta puedes situar al elemento en la tabla.
Utilizando de nuevo el simulador, ve recorriendo los elementos de la tabla en orden creciente de número atómico: desde el Hidrógeno al Helio, siguiendo por el Li, Be, B, etc (al terminar un periodo, pasas al primer elemento del siguiente). De esa forma, vas añadiendo un electrón cada vez que pasas al elemento siguiente (el electrón diferenciador). ¡Fíjate en las estructuras electrónicas!
En la imagen siguiente se reflejan las conclusiones que puedes obtener:
1. La zona amarilla es la zona s, porque los elementos situados en ella tienen su último electrón en un orbital s, que está precisamente en la capa dada por el periodo (en Li en la segunda capa, 2s, por estar el Li en el segundo periodo; en K en el 3s, etc). Se indica ns, donde n es el número del periodo.
2. En la zona verde el último electrón está en un orbital p, precisamente el dado por el número del periodo. Se indica np, donde n es el número del periodo.
3. En la zona azul el último electrón está en un orbital d, pero en el dado por el número anterior al periodo en el que se encuentra el elemento. Por eso se indica (n-1)d.
4. Finalmente, la zona marrón se indica (n-2)f ya que el último electrón está en un orbital f, pero dos unidades inferior al número del periodo.
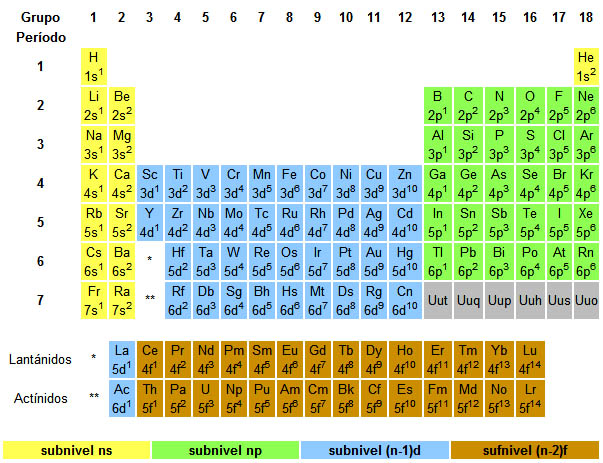
|
| Imagen 6 Elaboración propia |
Es importante que utilices el simulador hasta que tengas claras las zonas de la tabla. De todos modos, en este curso solamente vas a trabajar de forma general con elementos situados en las zonas s y p, llamados elementos representativos.
El hidrógeno y el helio
Fíjate en que el H tiene un electrón en la capa más externa (estrucutra 1s), lo mismo que los alcalinos (Li: 2s; Na: 3s; K: 4s; etc). Pero también le falta un electrón para completar la capa más externa, como le sucede a los halógenos (F, Cl, Br y I). Es decir, está en el grupo 1, pero, teniendo en cuenta su estructura electrónica, podría estar en el 17. Por ejemplo, tiene tendencia a perder un electrón, formando el ión H+, como los alcalinos, pero forma moléculas biatómicas dando lugar a la sustancia gaseosa H2, como los halógenos.
Algo parecido sucede con el helio, que está en el grupo 18 pero podría estar en el 2. Sus propiedades son las características de los gases nobles, y no se parece en nada a los alcalinotérreos.
En ambos casos, los elementos se sitúan en el grupo con el que tienen las semejanzas más relevantes.
|
El grupo 18 y el periodo 5.
| |
|
El grupo 8 y el periodo 5.
| |
|
El grupo 17 y el periodo 5.
| |
|
El grupo 7 y el periodo 5.
|
