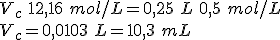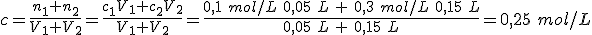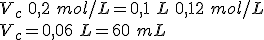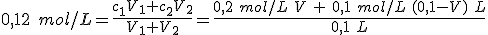4.1 Dilución y mezcla de disoluciones
 |
| Imagen 10 Elaboración propia |
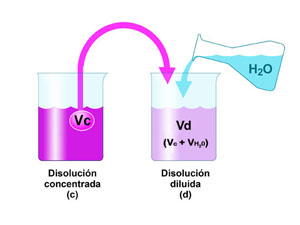
En el laboratorio se dispone de un HCl concentrado, aproximadamente 12 mol/L. Sin embargo, como reactivo se suele utilizar en concentraciones de 1 mol/L o menores. ¿Qué debes hacer para preparar la disolución que necesitas?
Si te fijas en el dibujo, verás que se trata de tomar un volumen Vc de la disolución concentrada, de concentración Cc, y añadir un volumen de agua, Vagua (es decir, Cc>Cd). El volumen de la disolución diluida es la suma de los volúmenes mezclados (Vd=Vc+Vagua).
Pero la cantidad de sustancia de soluto en el volumen Vc de disolución concentrada es la misma que en el volumen Vd de disolución diluida, ya que se añade solamente agua; es decir, nc=nd. Escribiendo las cantidades de sustancia en función de la concentración y del volumen, se tiene la expresión final, que es la que se utiliza habitualmente en los cálculos:
Fíjate en que sabrás tres de las cuatro magnitudes y calcularás la que te falte.
 |
| Imagen 11 ITE, Creative commons |
Al diluir una disolución, un volumen determinado de disolución se mezcla con agua, con lo que la concentración disminuye. Pero ¿qué sucede cuando se mezclan dos disoluciones de la misma sustancia con concentraciones diferentes?
Fíjate en la imagen, con dos disoluciones de la misma sustancia pero de diferente concentración: el color es más intenso cuanto más concentrada está la disolución. Al mezclar ambas disoluciones, el color será intermedio.
Si mezclas disoluciones de la misma concentración, la concentración de la mezcla permanecerá constante. Pero si los volúmenes son diferentes, la concentración cambiará, siendo intermedia con respecto a las de las disoluciones mezcladas.
Si los volúmenes mezclados son iguales, la concentración es exactamente la media: la disolución resultante de mezclar 50 mL de HCl 0,1 mol/L con 50 mL de HCl 0,3 mol/L tiene una concentración de 0,2 mol/L.
Dispones en el laboratorio de disoluciones de NaOH 0,2 mol/L y 0,1 mol/L. Necesitas preparar 100 mL de NaOH 0,12 mol/L. Explica dos formas de hacerlo.