1. Formulación y nomenclatura de compuestos inorgánicos
Todas las sustancias se conocen por su nombre, mientras que su fórmula permite conocer su composición. La nomenclatura facilita el paso de la fórmula química al nombre de la sustancia y viceversa.
En las fórmulas químicas de los compuestos inorgánicos formados al menos por dos elementos diferentes, la posición de los elementos sigue el orden creciente de electronegatividad (medida del poder de un átomo o grupo de átomos para atraer electrones).
Por convenio, la electronegatividad desciende en el sentido indicado por las flechas (relacionado con su estructura electrónica y posición en la Tabla Periódica):
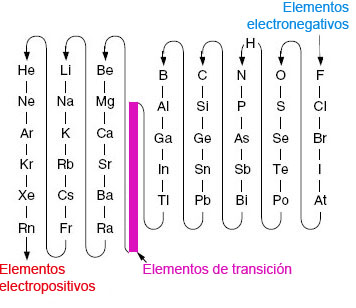 |
| Imagen 2 Elaboración propia |
Para nombrar los compuestos se sigue siempre el mismo orden: se empieza nombrando el último elemento y se acaba por el primero.
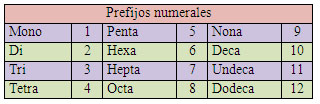
En la nomenclatura sistemática, para indicar la proporción estequiométrica de los elementos en un compuesto se utilizan los prefijos numerales, que se añaden a los nombres de los elementos a los que se refiere.
También se acepta el sistema de Stock, en el que para indicar (indirectamente) las proporciones estequiométricas de los elementos, se utilizan los números de oxidación o estados de oxidación. El número de oxidación del átomo correspondiente se sitúa entre paréntesis inmediatamente después de su nombre y se escribe en cifras romanas.
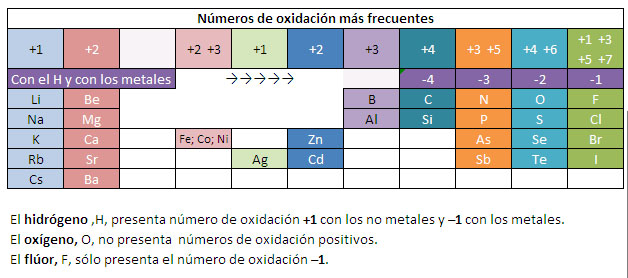
El número o estado de oxidación
de un átomo en una entidad molecular es un número positivo o negativo, que
representa la carga que quedaría en el átomo dado, si los pares electrónicos de
cada enlace que forman se asignaran al miembro más electronegativo del par de
enlace.
Convencionalmente se supone que:
- El número de oxidación de un ión simple coincide con su carga.
- En un elemento, el número de oxidación de los átomos es cero.
- La suma de los números de oxidación de los átomos que constituyen un compuesto neutro, multiplicados por los correspondientes subíndices, es cero.
- El número de oxidación del hidrógeno es +1 cuando se combina con elementos no metálicos y -1 cuando se combina con elementos metálicos.
- El número de oxidación del oxígeno es -2, salvo en los peróxidos, en los que es -1.
Verdadero Falso