5.2 Polaridad molecular
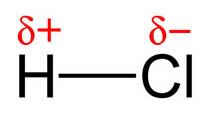 |
| Imagen 26 de elaboración propia |
Cuando se unen dos átomos de electronegatividad diferente, el par de electrones se coloca cerca del átomo que más tendencia tiene a atraerlo: el enlace es un enlace covalente polar, o simplemente polar. Sobre el átomo más electronegativo hay más densidad electrónica, y menos sobre el otro: se origina una cierta separación de carga, que no llega a ser total, porque entonces el enlace sería iónico por transferencia electrónica. Observa la situación en la molécula de HCl.
Hay moléculas con enlaces polares, como es el caso del CO2, pero debido a que es lineal las separaciones de carga se compensan y la molécula no es polar (es apolar). Sin embargo, son polares moléculas como el amoniaco (NH3) y el agua (H2O).
De la polaridad molecular dependen muchas propiedades de las sustancias: por ejemplo, la capacidad disolvente del agua, una de sus propiedades más características, se da precisamente por tratarse de una molécula polar; y el aceite y el agua no se mezclan porque una es una sustancia apolar mientras que la otra es polar.
Interacciones entre moléculas polares
Si una molécula es polar, manifiesta interacciones de naturaleza eléctrica con otras moléculas, orientándose unas con respecto a otras (el extremo positivo de una con el negativo de otra).