5.1 Estructuras electrónicas de Lewis
Para explicar el enlace covalente se representan las estructuras electrónicas de Lewis, en las que se indica cómo se distribuyen los electrones alrededor de cada átomo de la molécula. ¿Cómo se obtienen estas estructuras?
- Simplemente hay que contar cuántos electrones tienen en total en su capa más externa todos los átomos que forman la molécula, y distribuirlos en pares de manera que se cumpla la regla del octete. Cada par de electrones se representa con un par de puntos o con una raya.
- Hay que tener en cuenta que el hidrógeno siempre debe estar en los extremos de las moléculas, ya que con un par de electrones cumple la regla del octete (si estuviera entre dos átomos, formaría dos enlaces y estaría rodeado por dos pares de electrones), y que el oxígeno forma dos enlaces.
- También hay que considerar la posibilidad de formar enlaces dobles o triples entre dos átomos, si resulta necesario, y representar la molécula de forma simétrica con respecto a un átomo central.
Por ejemplo, en la molécula de agua hay en total ocho electrones para repartir en cuatro pares: seis proceden de la capa más externa del oxígeno y dos de los dos hidrógenos. Con dos pares se forman los dos enlaces O-H, y los dos restantes se asignan al oxígeno, que queda rodeado por dos pares compartidos y otros dos sin compartir, cumpliéndose la regla del octete.
En la imagen se representan las estructuras de Lewis de varias moléculas. Los pares sin compartir se indican con dos puntos para que los diferencies, pero se suelen indicar con una raya, igual que los compartidos.
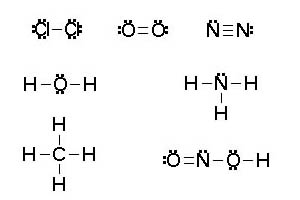 |
| Imagen 20 de elaboración propia |
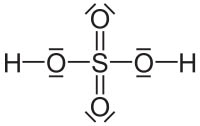 |
| Image 21 NEUROtiker, dominio público |
Excepciones a la regla del octete
Aunque se cumple en muchos casos, hay excepciones que se dan en sustancias muy conocidas. En la imagen puedes ver la molécula de ácido sulfúrico, en la que el átomo central está rodeado por seis pares de electrones, cuando la regla del octete indica que debiera estar rodeado por cuatro pares (ocho electrones).
En otros casos, el átomo central está rodeado por dos, tres o cinco pares de electrones, o incluso por un número impar de electrones.
Simuladores de estructuras
En todos los tipos de enlace se pueden construir modelos físicos de bolas y varillas para representar las estructuras formadas. En la imagen de la izquierda puedes ver un modelo de un compuesto del carbono, el 1-buteno.
Pero la imagen tridimensional animada permite tener una visión mucho más realista de las estructuras formadas, que se pueden manipular para girarlas, moverlas, acercarlas o incluso cambiar la forma de representar la estructura (varillas, bolas y varillas, etc.). Puedes imprimir un documento con las instrucciones elementales de manejo de las estructuras, y desde la imagen de la derecha acceder a una página con algunos ejemplos.
 |
 |
| Imagen 22 Renew, Creative commons |
Imagen 23 de elaboración propia |
|
| Imagen 24 de elaboración propia |