2.1 Simuladores
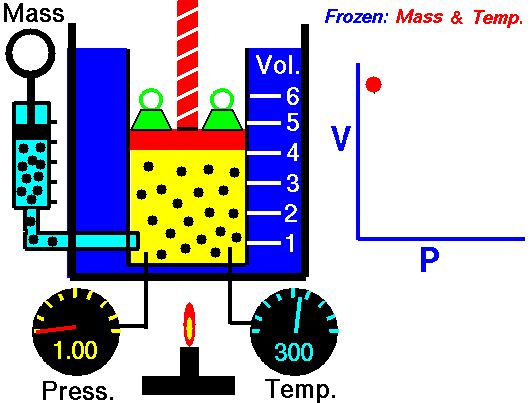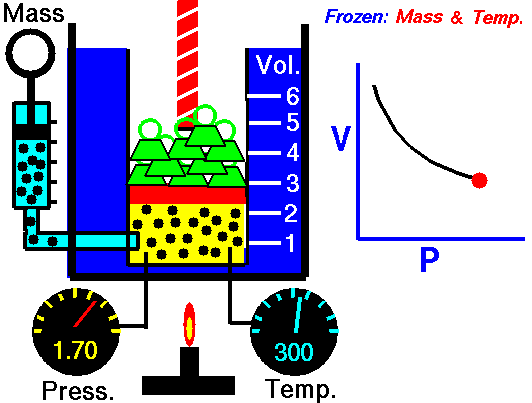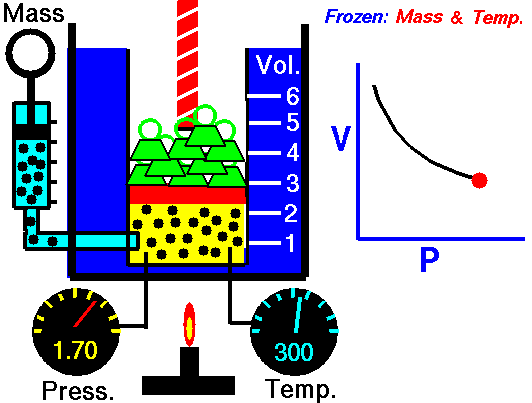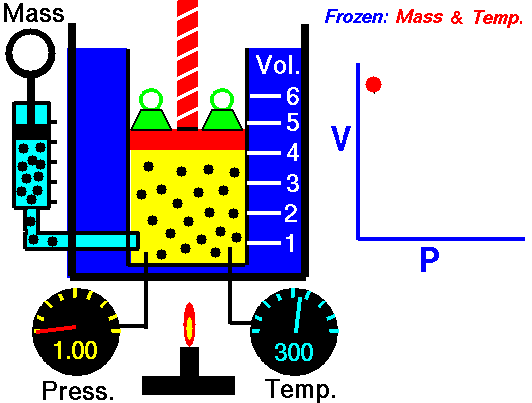
Observa la animación de la izquierda: al disminuir el volumen que
ocupa el gas es menor la superficie de choque y hay más choques por unidad de
tiempo (las partículas deben recorrer menos espacio hasta llegar a las paredes
del recipiente), por lo que la presión es mayor. Es decir, se cumple la ley de Boyle: al hacerse la presión doble, el volumen se reduce a la mitad.
 |
 |
| Animación 2 de la NASA, dominio público | Animación 3 de la NASA, dominio público |
Si te fijas ahora en la animación de la derecha, verás que el volumen se hace más grande al calentar, manteniéndose constante la presión: las partículas se mueven a mayor velocidad, por lo que chocan con más intensidad con las paredes del recipiente, que se agranda para mantener la presión constante.
La forma recta de la gráfica del volumen frente a la temperatura indica que son dos magnitudes proporcionales (V/T=cte), de acuerdo con la ley de Charles.
|
|
| Animación 4 de Proyecto TIGER, uso educativo |
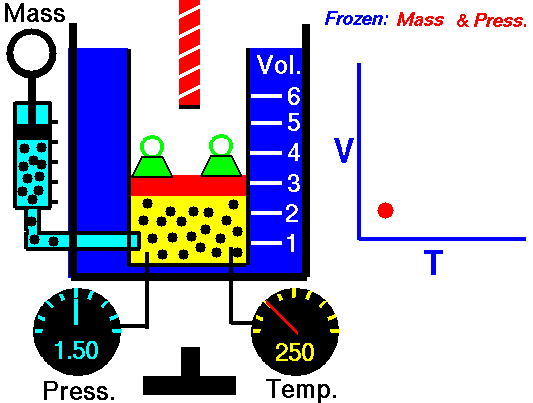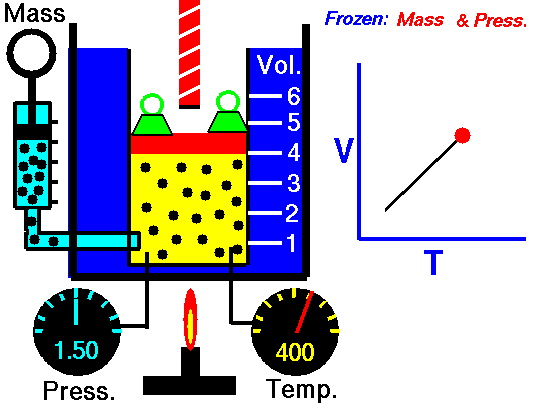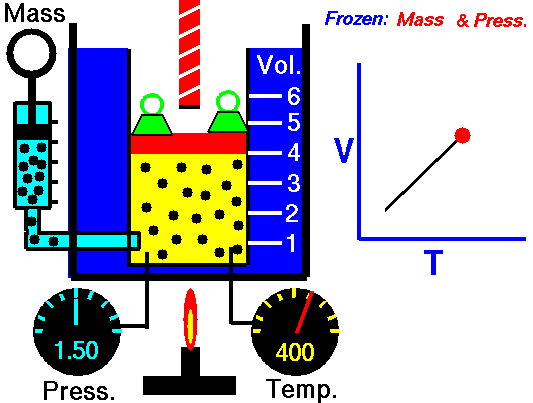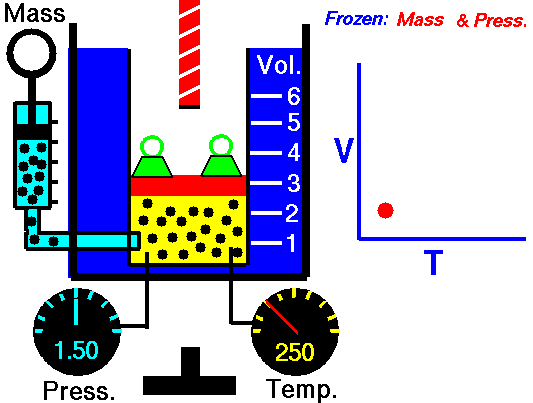
En la animación de la derecha, observa los valores de la presión y la temperatura y pulsa la tecla para calentar. Si el recipiente tiene un volumen fijo, las partículas del gas aumentan su energía cinética, por lo que chocan más veces por unidad de tiempo con las paredes del recipiente, al moverse más deprisa, y lo hacen con más intensidad. Por tanto, la presión aumenta.
Además, al llegar a una temperatura doble, también se duplica la presión, como se deduce de la ley de Gay-Lussac.
En las mezclas de gases, las partículas más grandes se mueven más despacio y las pequeñas más deprisa, pero su energía cinética es la misma: lo importante es el número de partículas, independientemente de cuáles sean. Por tanto, la presión de la mezcla depende del número total de partículas, que es la suma de las partículas que hay de cada tipo en una mezcla, como se indica en la ley de Dalton.
 |
| Imagen 11 de elaboración propia |
Justifica por qué se debe medir la presión de las ruedas de un coche después de haber circulado muy pocos kilómetros.
|
Porque el movimiento del coche hace que las partículas de aire se muevan más deprisa.
| |
|
Porque las ruedas se calientan por rozamiento con el suelo y la presión del aire interior aumenta.
| |
|
Para que el conductor no esté cansado, porque la presión no cambia.
|
El mecanismo de respiración
| Video 2 de dizzo95, uso libre |
Observa cómo respiramos las personas. Los pulmones están dentro de la caja torácica y cuando el músculo respiratorio (diafragma) baja, aumenta el espacio que pueden ocupar, por lo que la presión interior disminuye. Para igualarla con la exterior, entra aire. Al relajarse el diafragma, el efecto es el contrario, y se expulsa aire de los pulmones.
Date cuenta de que no se explica con ninguna de las leyes anteriores, porque en ellas no cambiaba la cantidad de gas en el sistema, que estaba cerrado, mientras que ahora está abierto, entrando o saliendo gas según resulte necesario.