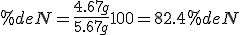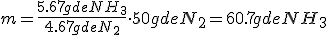3.1 Interpretación de las leyes ponderales
Observa la animación siguiente. Fíjate en que se mezclan dos gases, formados por partículas biatómicas de dos átomos de oxígeno (O2) o de nitrógeno (N2). Cuando se produce la reacción de formación de NO, se rompen uniones entre átomos de oxígeno por un lado y de nitrógeno por otro, formándose uniones entre ellos para obtener el nuevo gas.
|
|
|
Animación 2 Proyecto TIGER, uso educativo
|
Como puedes ver, el número total de átomos no cambia desde la situación inicial a la final: simplemente, están unidos de una forma diferente. Por tanto, la masa total tampoco varía, y se cumple la ley de conservación de la masa. En este caso, sobra nitrógeno, que es el reactivo en exceso.
Fíjate también en que siempre se une un átomo de nitrógeno con uno de oxígeno para formar este óxido de nitrógeno, con lo que la fórmula del óxido es NO; por tanto, la proporción de combinación en masa corresponderá siempre al cociente entre las masas de ambos átomos. En resumen, la proporción de combinación es constante.
Sin embargo, el nitrógeno puede unirse con el oxígeno para formar diferentes óxidos; por ejemplo, NO y NO2. La proporción de combinación es diferente en ambos casos, ya que hay el doble de oxígeno en el segundo que en el primero para la misma cantidad de nitrógeno.
Precisamente las fórmulas de las sustancias se establecieron por aplicación de las leyes ponderales, junto con una ley específica de los gases, como verás en temas posteriores. La fórmula empírica indica la proporción de átomos de cada tipo que hay en el compuesto.
 |
| Imagen 14 de elaboración propia |